Protocol terapeutic
conform ordin MS/CNAS NR 702/133/2022
L01XE54 – DCI GILTERITINIB
L01XE54 – DCI GILTERITINIB
Citeste mai mult: https://www.formaremedicala.ro/l01xe54-dci-gilteritinib/
I. Indicatia terapeutica:
Leucemie Acută Mieloidă (LAM) refractară sau recidivantă cu mutație FLT3
II. Criterii de Includere:
Pacienții adulți cu leucemie acută mieloidă (LAM) refractară sau recidivantă cu mutație
FLT3. Înainte de administrarea gilteritinib, pacienții cu LAM refractară sau recidivantă
trebuie să aibă confirmarea unei mutații a tirozin-kinazei-3 similare FMS (FLT3) (duplicare
tandem internă [internal tandem duplication, ITD] sau în domeniul tirozin-kinazei [tyrosine
kinase domain, TKD]).
Gilteritinib poate fi reluat pentru pacienții în urma unui transplant de celule stem
hematopoietice (TCSH).
III. Contraindicatii:
a) Hipersensibilitate la substanța activă sau la oricare dintre excipienții enumerați.
b) Insuficiență hepatică severă (clasa C Child-Pugh)
IV. Tratament (doze, condiţiile de scădere a dozelor, perioada de tratament):
Tratamentul cu Gilteritinib trebuie inițiat și supravegheat de un medic cu experiență în
utilizarea terapiilor anticanceroase si se administreaza in monoterapie.
Doze
Doza inițială recomandată este de 120 mg de gilteritinib (trei comprimate a 40 mg) o dată pe
zi.
În absența unui răspuns [pacientul nu a obținut remisiunea completă compozită (RCc)] după 4
săptămâni de tratament), doza poate fi crescută la 200 mg (cinci comprimate de 40 mg) o dată
pe zi, dacă este tolerată sau justificată clinic.
Se recomandă continuarea tratamentului până când pacientul nu mai obține beneficii clinice
Gilteritinib sau până la apariția unei toxicități inacceptabile. Răspunsul ar putea fi întârziat;
prin urmare, se recomandă continuarea tratamentului timp de cel puțin 6 luni, pentru a permite
obținerea unui răspuns clinic.
Recomandările privind întreruperea, reducerea și încetarea dozei de Gilteritinib la pacienții cu
LMA refractară sau recidivantă :

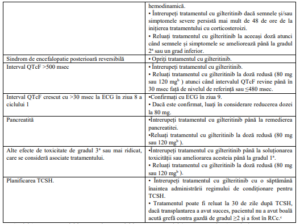
a. Gradul 1 este ușor, gradul 2 este moderat, gradul 3 este sever, gradul 4 poate pune viața în pericol.
b. Doza zilnică poate fi redusă de la 120 mg la 80 mg sau de la 200 mg la 120 mg.
c. RCc este definită ca rata de remisiune a tuturor RC, RCp [RC obținut cu excepția recuperării incomplete a
trombocitelor (<100 x 109
/L)] și RCi (a obținut toate criteriile pentru RC cu excepția recuperării hematologice
incomplete cu neutropenie reziduală <1 x 109
/L cu sau fără recuperarea completă a trombocitelor).
Nota:
Gilteritinib este destinat administrării orale. Comprimatele pot fi administrate cu sau fără
alimente. Acestea trebuie înghițite întregi, cu apă, și nu trebuie rupte sau zdrobite. Gilteritinib
trebuie administrat la aproximativ aceeași oră în fiecare zi. Dacă o doză este omisă sau nu este
administrată la ora obișnuită, trebuie să administrați doza cât mai curând posibil în aceeași zi
și trebuie să reveniți la programul normal în ziua următoare. Dacă apar vărsături după
administrarea dozei, pacienților nu trebuie să li se mai administreze încă o doză, ci trebuie să
revină la programul normal în ziua următoare.
V. Monitorizarea tratamentului si Precautii:
• Se recomandă efectuarea de teste biochimice, care să includă nivelul creatinfosfokinazei înainte de inițierea tratamentului, în ziua 15 și lunar pe tot parcursul
tratamentului.
• Se recomandă efectuarea unei electrocardiograme (ECG) înaintea inițierii
tratamentului cu gilteritinib, în zilele 8 și 15 ale ciclului 1 și înaintea începerii
următoarelor trei luni de tratament. Tratamentul cu gilteritinib trebuie întrerupt la
pacienții care au QTcF >500 msec. Decizia de a reintroduce tratamentul cu gilteritinib
după un eveniment de prelungire a QT ar trebui să se bazeze pe o analiză atentă a
beneficiilor și riscurilor. Dacă tratamentul cu gilteritinib este reintrodus la o doză
redusă, trebuie efectuată o ECG după ziua 15 de la administrare și înainte de începerea
următoarelor trei luni de tratament.
• Dacă se suspectează apariția sindromului de diferențiere, trebuie inițiată terapia cu
corticosteroizi, sub monitorizare hemodinamică, până la remedierea simptomelor.
Dacă semnele și/sau simptomele severe persistă mai mult de 48 de ore de la inițierea
tratamentului cu corticosteroizi, tratamentul cu gilteritinib trebuie întrerupt până când
semnele și simptomele nu mai sunt severe. Tratamentul cu corticosteroizi poate fi
redus treptat după remedierea simptomelor și trebuie administrat cel puțin 3 zile.
Simptomele sindromului de diferențiere pot să recidiveze în cazul întreruperii
premature a tratamentului cu corticosteroizi.
• Dacă se suspectează apariția sindromului de encefalopatie posterioară reversibilă
(SEPR), aceasta trebuie confirmată prin metode de imagistică medicală, preferabil prin
imagistică prin rezonanță magnetică (IRM). Se recomandă întreruperea tratamentului
cu gilteritinib la pacienții care dezvoltă SEPR.
• Pacienții care dezvoltă semne și simptome ce sugerează apariția pancreatitei trebuie
evaluați și monitorizați.Tratamentul cu gilteritinib trebuie întrerupt și poate fi reluat la
doză redusă atunci când semnele și simptomele de pancreatită au fost remediate
• Gilteritinib nu este recomandat pentru pacienți cu insuficiență hepatică severă (clasa C
Child-Pugh), deoarece siguranța și eficacitatea nu au fost evaluate pentru această
populație.
• Administrarea concomitentă de inductori ai CYP3A/P-gp poate determina reducerea
expunerii la gilteritinib și, în consecință, un risc de lipsă de eficacitate. Prin urmare,
trebuie evitată utilizarea concomitentă a gilteritinib cu inductori puternici ai
CYP3A4/P-gp. Se impune precauția la prescrierea concomitentă a gilteritinib și a
medicamentelor puternic inhibitoare ale CYP3A, P-gp și/sau proteinei de rezistență la
cancer mamar (BCRP) (cum sunt, dar fără a se limita la, voriconazol, itraconazol,
posaconazol și claritromicină), deoarece acestea pot crește expunerea la gilteritinib.
Trebuie luată în calcul prescrierea unor medicamente alternative, care nu inhibă
puternic activitatea CYP3A, P-gp și/sau BCRP. În situațiile în care nu există
alternative terapeutice satisfăcătoare, pacienții trebuie monitorizați îndeaproape pentru
a observa cazurile de toxicitate pe parcursul administrării gilteritinib.
• Gilteritinib poate reduce efectele medicamentelor care țintesc receptorul 5HT2B sau
receptorii nespecifici sigma. Prin urmare, trebuie evitată utilizarea concomitentă a
gilteritinib cu aceste medicamente, cu excepția cazului în care această combinație este
considerată esențială pentru îngrijirea pacientului.
• La femeile aflate la vârsta fertilă se recomandă efectuarea unui test de sarcină cu șapte
zile înainte de inițierea tratamentului cu gilteritinib. Se recomandă ca femeile aflate la
vârsta fertilă să utilizeze metode eficiente de contracepție (metode care asigură un risc
de sarcină sub 1%) pe parcursul tratamentului și timp de 6 luni după tratament. Nu se
știe dacă tratamentul cu gilteritinib poate reduce eficiența contraceptivelor hormonale
și, prin urmare, femeile care folosesc contraceptive hormonale ar trebui să adauge o
metodă de contracepție cu barieră. Bărbații cu potențial de reproducere trebuie sfătuiți
să utilizeze metode eficiente de contracepție pe parcursul tratamentului și timp de cel
puțin 4 luni după ultima doză de gilteritinib. Gilteritinib nu este recomandat în timpul
sarcinii și la femei aflate la vârsta fertilă, care nu utilizează măsuri contraceptive
eficiente. Alăptarea trebuie întreruptă pe parcursul tratamentului cu gilteritinib și timp
de cel puțin două luni după ultima doză.
VI. Prescriptori: tratamentul se initiaza si se continua de catre medicii in specialitatea
hematologie sau oncologie clinică.”