Protocol terapeutic
conform ordin MS/CNAS NR 564/499/2021
L04AX04 – DCI LENALIDOMIDUM
L04AX04 – DCI LENALIDOMIDUM
Citeste mai mult: https://www.formaremedicala.ro/l04ax04-dci-lenalidomidum/
I. DEFINIȚIA AFECȚIUNII
• Mielomul multiplu (MM)
II. CRITERII DE INCLUDERE ÎN TRATAMENTUL SPECIFIC
• Lenalidomida, ca tratament combinat, este indicata pentru tratamentul pacienţilor adulţi
cu mielom multiplu netratat anterior care nu sunt eligibili pentru transplant de celule stem.
• Lenalidomida este indicată, în asociere cu dexametazonă, pentru tratamentul pacienţilor
adulţi cu mielom multiplu cărora li s-a administrat cel puţin un tratament anterior.
• Lenalidomida ca monoterapie, este indicata pentru tratamentul de întreţinere al
pacienţilor adulţi cu mielom multiplu nou-diagnosticat care au fost supuşi
transplantului autolog de celule stem
• Indicat în combinaţii terapeutice conform ghidurilor ESMO şi NCCN actualizate.
III. CRITERII DE EXCLUDERE
• Hipersensibilitate la substanţa activă sau la oricare dintre excipienţi
• Femei gravide
• Femei aflate în perioada fertilă, cu excepţia cazului în care sunt îndeplinite toate condiţiile
specificate în Programul de prevenire a sarcinii
• Pacienţi incapabili să urmeze sau să respecte măsurile contraceptive necesare
IV. TRATAMENT
Considerații generale, pentru toate indicaţiile descrise mai jos:
• Regimul de dozaj va fi modificat în funcţie de datele clinice şi de laborator
• Ajustările de doze, în timpul tratamentului şi la reluarea tratamentului, sunt recomandate
pentru gestionarea trombocitopeniei de Gradul 3 sau 4, neutropeniei sau a altor forme de
toxicitate de Gradul 3 sau 4, considerate a fi asociate tratamentului cu lenalidomidă.
• În cazul apariţiei neutropeniei, trebuie să se considere posibilitatea utilizării factorilor de
creştere pentru tratarea pacienţilor.
• Dacă au trecut mai puţin de 12 ore de la omiterea unei doze, pacientul poate lua doza
respectivă.
• Dacă au trecut mai mult de 12 ore de la omiterea unei doze, pacientul nu trebuie să mai ia
doza omisă şi va lua doza următoare a doua zi, la ora obişnuită.
A. Tratamentul pacienţilor adulţi cu mielom multiplu netratat anterior care nu sunt
eligibili pentru transplant de celule stem.
A.1 Lenalidomidă în asociere cu dexametazonă până la progresia bolii la pacienţii care nu
sunt eligibili pentru transplant de celule stem
Tratamentul cu lenalidomidă nu trebuie iniţiat dacă NAN < 1,0 x 109 /l şi/sau numărul de
trombocite < 50 x 109 /l.
Doza recomandată
Doza iniţială recomandată de lenalidomidă este de 25 mg, o dată pe zi, pe cale orală, în zilele 1
până la 21 ale ciclurilor repetitive de 28 zile.
Doza recomandată de dexametazonă este de 40 mg, o dată pe zi, pe cale orală, în zilele 1, 8, 15 şi
22 ale ciclurilor repetitive de 28 zile. Pacienţii pot continua tratamentul cu lenalidomidă şi
dexametazonă până la progresia bolii sau instalarea intoleranţei.
Etapele reducerii dozelor
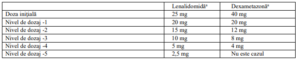
a Reducerea dozelor pentru ambele medicamente poate fi gestionată separat.
Trombocitopenie

a În cazul apariţiei toxicităţii de limitare a dozei (TLD) > ziua 15 a unui ciclu, dozajul de lenalidomidă va fi întrerupt
cel puţin pe durata rămasă a ciclului curent de 28 de zile
Număr absolut de neutrofile (NAN) – neutropenie


a La discreția medicului, dacă neutropenia este singura toxicitate la orice nivel de dozaj, se poate adăuga factorul de
stimulare a coloniilor granulocitare (FSC-G) și menține nivelul de dozaj al lenalidomidei.
În cazul toxicităţii hematologice, doza de lenalidomidă poate fi reintrodusă la următorul
nivel superior de dozaj (până la doza iniţială) după ameliorarea funcţiei măduvei osoase
(fără nicio toxicitate hematologică timp de cel puţin 2 cicluri consecutive : NAN ≥1,5 x 109/l,
cu un număr de trombocite ≥ 100 x 109/l la începutul unui nou ciclu).
A.2 Lenalidomidă în asociere cu bortezomib și dexametazonă urmat de lenalidomidă în
asociere cu dexametazonă până la progresia bolii la pacienți neeligibili pentru
transplant
Tratament inițial: Lenalidomidă în asociere cu bortezomib și dexametazonă
Administrarea de lenalidomidă în asociere cu bortezomib și dexametazonă nu trebuie inițiată
dacă NAN este < 1,0 x 109
/l și/sau numărul de trombocite este < 50 x 109
/l.
Doza inițială recomandată de lenalidomidă este de 25 mg o dată pe zi, administrată pe cale orală,
în zilele 1 până la 14 ale fiecărui ciclu de 21 zile în asociere cu bortezomib și dexametazonă.
Bortezomib trebuie administrat prin injecție subcutanată (1,3 mg/m2 suprafață corporală), de două
ori pe săptămână, în zilele 1, 4, 8 și 11 ale fiecărui ciclu de 21 zile.
Pentru informații suplimentare cu privire la doză, schema de administrare și ajustările dozei
pentru medicamentele administrate concomitent cu lenalidomida, vezi Rezumatul
caracteristicilor produsului corespunzător.
Se recomandă până la opt cicluri de tratament de 21 zile (24 săptămâni de tratament inițial).
Continuarea tratamentului: Lenalidomidă în asociere cu dexametazonă până la progresia bolii
Se va continua administrarea de lenalidomidă 25 mg pe cale orală, o dată pe zi, în zilele 1 până la
21 ale ciclurilor repetate de 28 zile, în asociere cu dexametazonă.
Tratamentul trebuie continuat până la progresia bolii sau până la toxicitate inacceptabilă.
Etapele reducerii dozelor

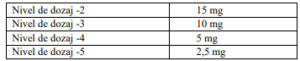
ª Reducerea dozei pentru toate medicamentele poate fi gestionată independent
Trombocitopenie
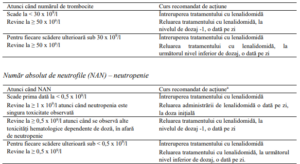
a La discreția medicului, dacă neutropenia este singura toxicitate la orice nivel de dozaj, se poate adăuga factorul de
stimulare a coloniilor granulocitare (FSC-G) și menține nivelul de dozaj al lenalidomidei.
A.3 Lenalidomidă în asociere cu melfalan şi prednison, urmată de întreţinere cu
lenalidomidă, la pacienţii care nu sunt eligibili pentru transplant.
Tratamentul cu lenalidomidă nu trebuie iniţiat dacă numărul absolut de neutrofile (NAN) < 1,5 x
109
/l şi/sau numărul de trombocite < 75 x 109
/L.
Doza recomandată
Doza iniţială recomandată este de 10 mg de lenalidomidă o dată pe zi, pe cale orală, în zilele 1
până
la 21 ale ciclurilor repetitive de 28 zile, timp de până la 9 cicluri, 0,18 mg/zi de melfalan, pe cale
orală, în zilele 1 până la 4 ale ciclurilor repetitive de 28 zile, 2 mg/zi de prednison, pe cale orală,
în zilele 1 până la 4 ale ciclurilor repetitive de 28 zile.
Pacienţii care finalizează 9 cicluri sau care nu pot finaliza tratamentul acociat din cauza
intoleranţei vor fi trataţi cu lenalidomidă în monoterapie, după cum urmează: 10 mg o dată pe zi,
pe care orală, în zilele 1 până la 21 ale ciclurilor repetitive de 28 zile, până la progresia bolii.
Etapele reducerii dozelor
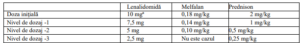
a Dacă neutropenia este singura formă de toxicitate la orice nivel de dozaj, se va adăuga factor de stimulare a
coloniilor formatoare de granulocite (G-CSF) şi se va menţine nivelul de dozaj al lenalidomidei.
Trombocitopenie

Număr absolut de neutrofile (NAN) – neutropenie
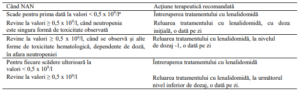
a La discreția medicului, dacă neutropenia este singura toxicitate la orice nivel de dozaj, se poate adăuga factorul de
stimulare a coloniilor granulocitare (FSC-G) și menține nivelul de dozaj al lenalidomidei.
B. Lenalidomida este indicată, în asociere cu dexametazonă, pentru tratamentul pacienţilor
adulţi cu mielom multiplu cărora li s-a administrat cel puţin un tratament anterior.
Tratamentul cu lenalidomidă nu trebuie iniţiat dacă NAN < 1,0 x 109
/l şi/sau numărul de
trombocite < 75 x 109
/l sau, dependent de infiltrarea măduvei osoase de către plasmocite, dacă
numărul de trombocite < 30 x 109
/l.
Doza recomandată
Doza iniţială recomandată este de 25 mg lenalidomidă, o dată pe zi, pe cale orală, în zilele 1 până
la 21 ale ciclurilor repetitive de 28 zile.
Doza recomandată de dexametazonă este de 40 mg, o dată pe zi, pe cale orală, în zilele 1 până la
4, 9 până la 12 şi 17 până la 20 ale fiecărui ciclu de 28 zile, pentru primele 4 cicluri de tratament
şi, ulterior, de 40 mg o dată pe zi, în zilele 1 până la 4, la fiecare 28 zile.
Medicii prescriptori trebuie să evalueze cu atenţie doza de dexametazonă care va fi utilizată,
luând în considerare afecţiunea şi starea bolii pacientului.
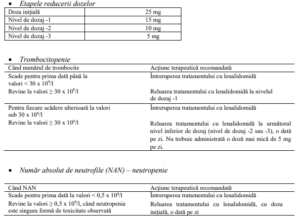

a La discreția medicului, dacă neutropenia este singura toxicitate la orice nivel de dozaj, se poate adăuga factorul
de stimulare a coloniilor granulocitare (FSC-G) și menține nivelul de dozaj al lenalidomidei
Combinația lenalidomidă si dexametazonă poate fi utilizată pentru tratamentul pacienților adulți
cu mielom multiplu cărora li s-a administrat cel puțin un tratament anterior si în asociere cu alte
terapii conform ghidurilor ESMO si NCCN actualizate.
C. Lenalidomidă, ca monoterapie, este indicata pentru tratamentul de întreţinere al
pacienţilor adulţi cu mielom multiplu nou-diagnosticat care au fost supuşi
transplantului autolog de celule stem
Întreţinerea cu lenalidomidă la pacienţii care au fost supuşi transplantului autolog de celule stem
(TACS) Întreţinerea cu lenalidomidă trebuie iniţiată după recuperarea hematologică adecvată
ulterioară TACS la pacienţii fără semne de progresie. Tratamentul cu lenalidomidă nu trebuie
iniţiat dacă numărul absolut de neutrofile (NAN) este < 1,0 x 109 /l, şi/sau numărul de trombocite
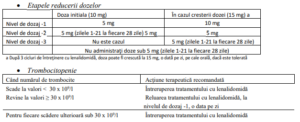
este < 75 x 109 /l. Doza recomandată Doza iniţială recomandată de lenalidomidă este de 10 mg, o
dată pe zi, pe cale orală, administrată continuu (în zilele 1-28 ale ciclurilor repetitive de 28 zile),
până la progresia bolii sau apariţia intoleranţei. După 3 cicluri de întreţinere cu lenalidomidă,
doza poate fi crescută la 15 mg, o dată pe zi, pe cale orală, dacă este tolerată.
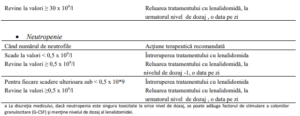
D. La administrarea lenalidomidei în asociere cu alte medicamente (combinatii terapeutice
conform ghidurilor ESMO şi NCCN actualizate, înainte de inițierea tratamentului
trebuie consultat Rezumatul caracteristicilor produsului corespunzător)
V. PRECAUȚII ȘI ATENȚIONĂRI:
Se recomandă profilaxia cu anticoagulante şi antiagregante la pacienţii care primesc terapie
cu lenalidomida.
Pacienţi cu insuficienţă renală
Lenalidomida este excretată în principal pe cale renală; pacienţii cu grade mai pronunţate de
insuficienţă renală pot avea o toleranţă redusă la tratament.
Alegerea dozei trebuie făcută cu prudenţă şi se recomandă monitorizarea funcţiei renale.
Nu sunt necesare ajustări ale dozelor pentru pacienţii cu insuficienţă renală uşoară şi mielom
multiplu
Următoarele ajustări ale dozelor sunt recomandate în momentul iniţierii terapiei şi pe parcursul
tratamentului, în cazul pacienţilor cu insuficienţă renală moderată sau severă sau cu insuficienţă
renală în stadiu final.
Nu există experienţă cu studii de fază III privind insuficienţa renală în stadiu final (IRSF) (Clcr
< 30 ml/minut, necesitând dializă).


Atenţionări privind sarcina
Lenalidomida este asemănătoare din punct de vedere structural cu talidomida. Talidomida este o
substanţă activă cu efecte teratogene cunoscute la om, care determină malformaţii congenitale
grave, cu risc vital. La maimuţe lenalidomida a indus malformaţii similare celor descrise pentru
talidomidă Dacă lenalidomida este utilizată în timpul sarcinii se prevede apariţia unui efect
teratogen al lenalidomidei la om.
Condiţiile Programului de prevenire a sarcinii trebuie îndeplinite în cazul tuturor pacientelor, cu
excepţia cazurilor în care există dovezi sigure privind faptul că pacientele respective nu se mai
află în perioada fertilă.
Criterii pentru femeile care nu se mai află în perioada fertila
Se consideră că o pacientă sau partenera unui pacient de sex masculin se află în perioada fertilă,
cu excepţia cazurilor în care îndeplineşte cel puţin unul dintre următoarele criterii:
• vârsta peste 50 ani şi amenoree instalată în mod natural de peste 1 an (amenoreea instalată
în urma tratamentului citostatic sau în timpul alăptării nu exclude posibilitatea ca pacienta
să fie în perioada fertilă.)
• insuficienţă ovariană prematură confirmată de către un medic specialist ginecolog
• salpingo-ovarectomie bilaterală sau histerectomie în antecedente
• genotip XY, sindrom Turner, agenezie uterină.
Recomandări
Lenalidomida este contraindicată femeilor aflate în perioada fertilă, cu excepţia cazurilor în care
sunt îndeplinite toate condiţiile următoare:
• pacienta înţelege riscul teratogen prevăzut pentru făt
• pacienta înţelege necesitatea utilizării unor măsuri contraceptive eficace, în mod continuu,
începând cu cel puțin 4 săptămâni înaintea iniţierii tratamentului, pe toată durata
tratamentului şi timp de cel puțin 4 săptămâni după întreruperea definitivă a tratamentului
• pacienta aflată în perioada fertilă trebuie să urmeze toate recomandările privind măsurile
contraceptive eficace, chiar dacă prezintă amenoree
• pacienta trebuie să fie capabilă să aplice măsurile contraceptive eficace
• pacienta este informată şi înţelege posibilele consecinţele ale unei sarcini, precum şi
necesitatea de a consulta imediat un medic, în cazul în care există riscul de a fi gravidă
• pacienta înţelege necesitatea de a începe tratamentul imediat după ce i se eliberează
lenalidomida, în urma obţinerii unui rezultat negativ la testul de sarcină
• pacienta înţelege necesitatea de a efectua teste de sarcină şi acceptă efectuarea acestora la
fiecare 4 săptămâni, cu excepţia cazurilor de sterilizare tubară confirmată
• pacienta confirmă că înţelege riscurile şi precauţiile necesare asociate cu utilizarea
lenalidomidei.
Pentru pacienţii de sex masculin cărora li se administrează lenalidomidă, datele
farmacocinetice au demonstrat că lenalidomida este prezentă în sperma umană în cantităţi extrem
de mici în cursul tratamentului şi este nedetectabilă în sperma umană după 3 zile de la oprirea
administrării substanţei la subiecţii sănătoşi .Ca măsură de precauţie, şi luând în considerare
categoriile speciale de pacienţi cu timp de eliminare prelungit, precum cei cu insuficienţă renală,
toţi pacienţii de sex masculin cărora li se administrează lenalidomidă trebuie să îndeplinească
următoarele condiţii:
• să înţeleagă riscul teratogen prevăzut, în cazul în care au raporturi sexuale cu femei
gravide sau aflate în perioada fertilă
• să înţeleagă necesitatea utilizării prezervativelor dacă au raporturi sexuale cu femei
gravide sau aflate în perioada fertilă şi care nu utilizează măsuri contraceptive eficace
(chiar dacă pacientul este vasectomizat) pe parcursul tratamentului şi timp de cel puțin 7
zile după întreruperea administrării dozelor şi/sau oprirea tratamentului.
• să înţeleagă faptul că, dacă partenera sa rămâne gravidă în timp ce pacientul se află sub
tratament lenalidomidă, sau la scurt timp după ce acesta a încetat să ia lenalidomidă,
pacientul trebuie să îşi informeze imediat medicul curant şi să îşi trimită partenera la un
medic specializat sau cu experienţă în teratologie, pentru evaluare şi recomandări.
Pentru femeile aflate în perioada fertilă, medicul care prescrie medicamentul trebuie să se
asigure:
• pacienta îndeplineşte condiţiile specificate în Programul de prevenire a sarcinii, incluzând
confirmarea faptului că pacienta are o capacitate adecvată de înţelegere
• pacienta a luat cunoştinţă de condiţiile menţionate mai sus.
Contracepţie
Femeile aflate în perioada fertilă trebuie să utilizeze cel puțin o metodă contraceptivă eficace
timp de cel puțin 4 săptămâni înainte de tratament, pe durata tratamentului şi timp de cel puțin 4
săptămâni după întreruperea definitivă a tratamentului cu lenalidomidă, inclusiv pe durata
întreruperii temporare a tratamentului, cu excepţia cazului în care pacienta se angajează să
menţină o abstinenţă totală şi continuă, confirmată lunar. Dacă nu utilizează o metodă
contraceptivă eficace, pacienta trebuie să se adreseze personalului medical calificat, pentru
recomandări privind iniţierea contracepţiei.
Următoarele exemple pot fi considerate metode contraceptive adecvate:
• implantul
• dispozitivul intrauterin cu eliberare de levonorgestrel (DIU)
• acetatul de medroxiprogesteron, preparat retard
• sterilizarea tubară
• rapoarte sexuale numai cu un partener vasectomizat; vasectomia trebuie confirmată prin
două analize ale spermei cu rezultate negative
• anticoncepţionale care inhibă ovulaţia care conţin numai progesteron (desogestrel)
Datorită faptului că pacientele cu mielom multiplu, cărora li se administrează lenalidomidă în
cadrul unui tratament combinat, şi, în mai mică măsură, pacientele cu mielom multiplu cărora li
se administrează lenalidomidă în monoterapie, prezintă un risc crescut de tromboembolie
venoasă, nu se recomandă administrarea de contraceptive orale combinate acestor paciente.
Dacă o pacientă utilizează în mod obişnuit un contraceptiv oral combinat, acesta trebuie
înlocuit cu una dintre metodele contraceptive eficace enumerate mai sus. Riscul tromboemboliei
venoase se menţine timp de 4-6 săptămâni după întreruperea administrării unui contraceptiv oral
combinat. Eficacitatea contraceptivelor steroidiene poate fi redusă în timpul tratamentului
concomitent cu dexametazonă.
Implanturile şi dispozitivele intrauterine cu eliberare de levonorgestrel prezintă un risc crescut
de infecţie în momentul inserţiei şi de apariţie a hemoragiilor vaginale neregulate. Trebuie
evaluată necesitatea instituirii unui tratament profilactic cu antibiotice, în special la pacientele cu
neutropenie.
Dispozitivele intrauterine cu eliberare de cupru nu sunt în general recomandate, datorită
riscului potenţial de infecţie în momentul inserţiei şi de apariţie a unor pierderi de sânge
semnificative la menstruaţie, care pot determina complicaţii la pacientele cu neutropenie sau
trombocitopenie.
Teste de sarcină
Conform prevederilor locale, femeile aflate în perioada fertilă trebuie să efectueze, sub
supraveghere medicală, teste de sarcină având o sensibilitate de cel puţin 25 mUI/ml, aşa cum
este descris în continuare. Această cerinţă include femeile aflate în perioada fertilă, care practică
o abstinenţă totală şi continuă. În mod ideal, testul de sarcină, emiterea prescripţiei medicale şi
eliberarea medicamentului trebuie efectuate în aceeaşi zi. La femeile aflate în perioada fertilă,
lenalidomida trebuie eliberată într- un interval de 7 zile de la data emiterii prescripţiei medicale.
Înaintea iniţierii tratamentului
Testul de sarcină trebuie efectuat, sub supraveghere medicală, în timpul consultaţiei medicale
în care se prescrie lenalidomida sau într-un interval de 3 zile înaintea consultaţiei, în condiţiile în
care pacienta a utilizat o metodă contraceptivă eficace timp de cel puţin 4 săptămâni. Testul
trebuie să confirme faptul că pacienta nu este gravidă în momentul iniţierii tratamentului cu
lenalidomidă.
Monitorizarea pacientelor şi încheierea tratamentului
Testul de sarcină trebuie repetat, sub supraveghere medicală, la fiecare cel puțin 4 săptămâni,
inclusiv după cel puțin 4 săptămâni de la încheierea tratamentului, cu excepţia cazurilor de
sterilizare tubară confirmată. Aceste teste de sarcină trebuie efectuate în ziua consultaţiei
medicale în care se prescrie medicamentul sau în interval de 3 zile înaintea acestei consultaţii.
Precauţii suplimentare
Pacienţii trebuie instruiţi să nu dea niciodată acest medicament altei persoane, iar la sfârşitul
tratamentului să restituie farmacistului toate capsulele neutilizate pentru eliminarea sigură.
Pacienţii nu trebuie să doneze sânge în timpul tratamentului şi timp de cel puțin 7 zile
după întreruperea tratamentului cu lenalidomidă.
VI. CRITERII DE EVALUARE A EFICACITĂȚII TERAPEUTICE
Se utilizează criteriile elaborate de către Grupul Internațional de Lucru pentru Mielom
(IMWG)
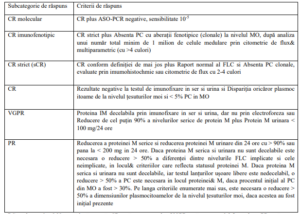
PC = plasmocite; MO = măduvă osoasă; CR = răspuns complet; VGPR = răspuns parțial foarte bun; PR = răspuns
parțial; ASO-PCR = reacția în lanț a polimerazei, specifică anumitor alele; FLC = lanțuri ușoare libere.
VII. PRESCRIPTORI
Medici specialisti hematologi (sau, dupa caz, specialisti de oncologie medicală, daca in
judet nu exista hematologi).
Continuarea tratamentului se face de către medicul hematolog sau oncolog.