Protocol terapeutic
conform ordin MS/CNAS NR 1206/233/2022
A16AX16 – GIVOSIRAN
A16AX16 – GIVOSIRAN
Citeste mai mult: https://www.formaremedicala.ro/a16ax16-givosiran/
Protocol terapeutic corespunzător poziției nr. 305 cod (A16AX16): DCI GIVOSIRAN
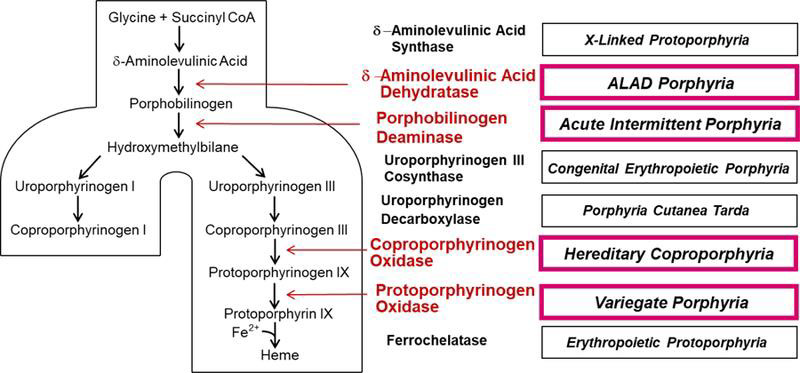
Porfirie Hepatică Acută (PHA) este o boală rară, care poate să apară în cadrul aceleiași familii. Cauza este deficiența unor enzime specifice cu funcție în biosinteză hemului, având ca rezultat o acumulare anormală de precursori porfirinici – acidul aminolevulinic (AAL) şi porfobilinogenul (PBG), acumulare responsabilă de manifestările clinice și modificările histologice.
O cantitate prea mare de AAL şi PBG poate leza nervii şi poate provoca crize grave de durere, greaţă, slăbiciune musculară şi modificări ale funcţiei mintale. Unele persoane cu porfirie hepatică acută pot avea, de asemenea, între crize, simptome precum dureri şi greaţă. Complicaţiile pe termen lung care pot fi observate la persoanele cu porfirie hepatică acută includ tensiune arterială mare, boli renale cronice şi boli hepatice.
Când intervin factori suplimentari, precum creșterea necesarului de hem sau scăderea suplimentară a activității enzimatice, apar manifestările clinice, fie sub forma de atacuri acute neuroviscerale, fie ca leziuni tegumentare sau ambele. Hem-ul este o componentă esențială a proteinelor care conțin fier numite hemoproteine, inclusiv hemoglobina.
Exista 4 tipuri de Porfirie Hepatică Acută (PHA) care necesita confirmare genetica:
• Porfiria Acută Intermitentă (PAI)
• Coproporfiria Ereditară (CPE)
• Porfiria Variegata (PV)
• Deficiența de AAL-D (Acid δ- AminoLevulinic Dehidrază)
I. Indicatia terapeutica (face obiectul unui contract cost –volum)
GIVOSIRAN este indicat pentru tratamentul porfiriei hepatice acute (PHA) la adulţi şi adolescenţi cu vârsta de 12 ani şi peste.
II. Criterii de eligibilitate pentru includerea în tratament cu Givosiran
II.1. Criterii de includere in tratament
Pacienti adulti si adolescenti cu varsta de 12 ani si peste, cu diagnostic genetic confirmat de Porfirie hepatica acuta.
Porfiria acută intermitentă (PAI), cea mai frecventă porfirie acută, rezultă din mutația celei de-a treia enzime din calea de biosinteză a hemului, cunoscută sub numele de porfobilinogen deaminază (PBGD) sau hidroximetilbilan sintază (HMBS).
Coproporfiria ereditară (CPE) și Porfiria variegata (PV) rezultă din mutația enzimei a șasea și a șaptea din cale [coproporfirinogen oxidazei (CPOX) și respectiv protoporfirinogen oxidazei (PPOX)]. Substraturile acestor enzime se acumulează în ficat în CPE și PV- se crede că inhibă PBGD, crescând astfel AAL și PBG și provocând simptome neurologice. Acești porfirinogeni (adică porfirinogeni reduși) se oxidează și la porfirinele corespunzătoare, care sunt fotosensibilizante și pot provoca leziuni cutanate cu vezicule. Creșterile AAL și PBG pot fi mai
puțin proeminente în CPE și PV decât în PAI. Cu toate acestea, atacurile CPE și PV pot fi severe și pot pune viața în pericol.
Porfiria prin deficiența de AAL dehidrază (acid δ- aminolevulinic dehidrază) se datorează mutației AALD, a doua enzimă din cale și este foarte rară. Analizele de laborator biochimice arată
creșteri marcate ale AAL urinară și ale coproporfirinei III și ale protoporfirinei eritrocitare libere.
Tablou clinic
Clinic, porfiriile se divid în două mari categorii: porfiriile acute, cu simptome neuropsihiatrice
și porfiriile cutanate, care au ca trăsătură specifică fotosensibilitatea.
Porfiria acută intermitentă, porfiria variegata și coproporfiria ereditară se manifestă clinic
prin atacuri acute neuroviscerale. Crizele acute de porfirie se produc pe fondul existenței unui
deficit enzimatic care este amplificat de acţiunea unor factori dobândiţi (de exemplu: estrogeni,
cure de slăbire, consum de alcool şi anumite medicamente) şi se datorează afectării sistemului
nervos central, periferic sau vegetativ. Se caracterizează prin dureri abdominale asociate cu greaţă,
vărsături şi constipaţie, rareori diaree. De asemenea, pot fi prezente hipertensiunea arterială,
tahicardia, hiponatremia (consecinţa pierderilor de sodiu sau a afectării hipotalamice – SIADH),
mialgii, convulsii (fie prin dezechilibru electrolitic, fie prin afectare nervoasă), neuropatie motorie
progresivă care poate mima sindromul Guillan-Bare şi poate necesita suport ventilator. Simptome
psihiatrice, precum depresia, insomnia, agitaţia, confuzia ori halucinaţiile, se asociază adesea
tabloului clinic, însă sunt reversibile odată cu ameliorarea stării generale.
Două dintre porfiriile acute prezintă și fotosensibilitate: coproporfiria ereditară si porfiria
variegata: aceasta este causata de fotoactivarea porfirinelor care duce la producerea unor specii
reactive de oxigen ce lezează celulele dermului.
II.2. Criterii de excludere
Lipsa confirmarii diagnosticului pentru cele 4 tipuri de Porfirie Hepatică Acută (PHA).
III.Tratament
Givosiran este un acid ribonucleic interferent scurt (ARN-is), dublu-catenar;
Givosiran determină printr-un process natural de interferenta, degradarea acidului ribonucleic mesager (ARNm) responsabil de sinteza în hepatocite a enzimei AALS1 (acid aminolevulinic sintazei 1).
Rezulta astfel o reducere aproape de normal pentru AALS1 indus hepatic.
Acest lucru duce la scaderea concentrațiilor plasmatice ale acid aminolevulinic (AAL) şi porfobilinogen (PBG), factorii cauzali-cheie ai crizelor şi ai altor manifestări cronice ale PHA.
În ceea ce priveste tratamentul, trebuie subliniată importanţa profilaxiei crizei de porfirie la persoanele cunoscute cu această afecţiune.
Doze
Doza recomandată de GIVOSIRAN este de 2,5 mg/kg o dată pe lună, administrată prin injecţie subcutanată. Doza se bazează pe greutatea corporală efectivă.
Doza administrată pacientului (în mg) şi volumul (în ml) trebuie calculate după cum urmează:
• Greutatea corporală a pacientului (kg) × doza (2,5 mg/kg) = cantitatea totală (mg) de medicament care trebuie administrată.
• Cantitatea totală (mg) împărţită la concentraţia flaconului (189 mg/ml) = volumul total de medicament (ml) care trebuie injectat.
• În studiul controlat cu placebo la pacienţi cu PHA tratați cu givosiran 2,5 mg/kg o dată pe lună (ENVISION), au fost observate reduceri mediane de la valoarea iniţială a AAL şi PBG urinare de 83,7% şi, respectiv, 75,1%, la 14 zile după administrarea primei doze. Reducerile maxime ale valorilor AAL şi PBG au fost obţinute în jurul lunii 3, cu reduceri mediane de la valoarea iniţială de 93,8% pentru AAL şi de 94,5% pentru PBG şi aceste valori au fost menţinute prin administrare repetată o dată pe lună.
• Datele observate şi modelarea au demonstrat că schema terapeutică cu administrarea o dată pe lună a dozei de givosiran 2,5 mg/kg a cauzat o reducere mai mare şi o fluctuaţie mai mică a valorilor AAL, comparativ cu utilizarea de doze mai mici de 2,5 mg/kg sau cu schema terapeutică cu administrare o dată la 3 luni.
• Concentraţiile plasmatice ale givosiranului nu reflectă extinderea sau durata activităţii farmacodinamice. Întrucât givosiranul are ca țintă terapeutică ficatul, concentraţiile plasmatice scad rapid datorită absorbţiei la nivel hepatic. În ficat, givosiranul prezintă o perioadă de înjumătăţire prelungită, care duce la o durată mai lungă a efectului farmacodinamic, efect ce se menţine în cazul utilizării schemei terapeutice cu administrare lunară.
Doză omisă
Dacă o doză este omisă, tratamentul trebuie administrat cât mai curând posibil. Schema terapeutică trebuie reluată conform utilizării la intervale lunare, după administrarea dozei omise.
Modificarea dozei în caz de reacţii adverse
La pacienţii cu creşteri ale concentrațiilor plasmatice ale transaminazelor relevante clinic, care au întrerupt administrarea dozei şi care prezintă o îmbunătăţire ulterioară a concentrațiilor plasmatice ale transaminazelor, poate fi avută în vedere o reluare a terapiei cu doza de 1,25 mg/kg, administrată o dată pe lună.
Mod de administrare:
Doar pentru administrare subcutanată.
Acest medicament este furnizat sub formă de soluţie gata de utilizare, într-un flacon destinat unei
singure utilizări.
• Volumul necesar de GIVOSIRAN trebuie calculat pe baza dozei recomandate în funcţie de greutate.
Volumul maxim acceptabil pentru o singură injecţie este de 1,5 ml. Dacă doza este mai mare de 1 ml, este necesar mai mult de un flacon.
• Dozele care necesită mai mult de 1,5 ml trebuie administrate sub formă de mai multe injecţii (doza lunară totală împărţită în mod egal între seringi, cu fiecare injecţie conţinând aproximativ acelaşi volum) pentru a reduce la minimum disconfortul posibil la nivelul locului de injectare din cauza volumului injecţiei.
• Acest medicament trebuie injectat subcutanat la nivelul abdomenului; locurile alternative de injectare includ coapsa sau partea superioară a braţului.
• Pentru injecţii sau doze ulterioare, se recomandă schimbarea locului de injectare.
• Acest medicament nu trebuie administrat în ţesut cicatricial sau în zone eritematoase, inflamate sau tumefiate.
Reacţii adverse
Rezumatul profilului de siguranţă conform cu Rezumatul Caracteristicilor Produsului disponibil pe site-ul EMA.
Perioada de tratament
Tratament cronic.
Tratamentul continuă la pacientii cu indicatia terapeutică până la toxicitate semnificativă sau retragerea consimţământului.
IV.Contraindicatii
Hipersensibilitate severă (de exemplu, anafilaxie) la substanţa activă sau la oricare dintre excipienţii.
V.Atentionari si precautii speciale pentru utilizare
Grupe speciale de pacienţi
Vârstnici
Nu este necesară ajustarea dozei la pacienţii cu vârsta > 65 ani
Insuficienţă hepatică
Nu este necesară ajustarea dozei la pacienţii cu insuficienţă hepatică uşoară (bilirubinemie ≤1 × limita superioară a valorilor normale (LSN) şi concentrație plasmatică a aspartat aminotransferazei (AST) >1 × LSN sau bilirubinemie >1 × LSN până la 1,5 × LSN). GIVOSIRAN nu a fost studiat la pacienţi cu insuficienţă hepatică moderată sau severă.
Insuficienţă renală
Nu este necesară ajustarea dozei la pacienţii cu insuficienţă renală uşoară, moderată sau severă (rata estimată de filtrare glomerulară [GFRe] ≥15 până la <90 ml/min /1,73 m²). GIVOSIRAN nu a fost studiat la pacienţii cu boală renală în stadiu terminal sau la pacienţii dializaţi
Copii şi adolescenţi
Nu este necesară ajustarea dozei pentru pacienţii cu vârsta ≥12 până la <18 ani. Siguranţa şi eficacitatea GIVOSIRAN la copii cu vârsta <12 ani nu au fost stabilite. Nu sunt disponibile date.
Datele non-clinice nu au evidenţiat niciun risc special pentru om pe baza studiilor convenţionale farmacologice privind evaluarea siguranţei, toxicitatea după doze repetate, genotoxicitatea, toxicitatea asupra funcţiei de reproducere şi dezvoltării.
Fertilitatea, sarcina şi alăptarea
Sarcina
Datele provenite din utilizarea givosiranului la femeile gravide sunt inexistente sau limitate. Studiile la animale au evidențiat efecte toxice asupra funcției de reproducere, în prezenţa toxicităţii materne. Utilizarea acestui medicament poate fi luată în considerare în timpul sarcinii, ţinându-se cont de beneficiile pentru sănătate preconizate pentru femeie şi riscurile potenţiale pentru făt.
Alăptarea
Nu se cunoaşte dacă givosiranul se excretă în laptele uman. Nu se poate exclude un risc pentru nou- născuţi/sugari. Datele farmacodinamice/toxicologice disponibile la animale au evidențiat excreţia givosiranului în lapte. Trebuie luată decizia fie de a întrerupe alăptarea, fie de a întrerupe/de a se abţine de la tratamentul cu givosiran având în vedere beneficiul alăptării pentru copil şi beneficiul tratamentului pentru femeie.
Fertilitatea
Nu există date privind efectul givosiranului asupra fertilităţii la om. Studiile la animale nu au evidențiat niciun impact asupra fertilităţii masculine sau feminine.
Genotoxicitate/carcinogenitate
Givosiranul nu a prezentat un potenţial genotoxic in vitro şi in vivo.
VI.Monitorizarea tratamentului/criterii de evaluare a eficacitatii terapeutice
In monitorizarea tratamentului cu GIVOSIRAN se urmareste obtinerea controlului biochimic pentru acidul delta-aminolevulinic (AAL) si porfobilinogen (PBG), in cadrul contextului ameliorarii/reducerii intensitatii tabloului clinic al bolii. Se recomanda evaluarea INITIALA dupa primele 3 luni de tratament urmata de evaluarea PERIODICA la 6 luni.
• În studiul controlat cu placebo la pacienţi cu PHA tratați cu givosiran 2,5 mg/kg o dată pe lună (ENVISION), au fost observate reduceri mediane de la valoarea iniţială a AAL şi PBG urinare de 83,7% şi, respectiv, 75,1%, la 14 zile după administrarea primei doze. Reducerile maxime ale valorilor AAL şi PBG au fost obţinute în jurul lunii 3, cu reduceri mediane de la valoarea iniţială de 93,8% pentru AAL şi de 94,5% pentru PBG şi aceste valori au fost menţinute prin administrare repetată a GIVOSIRAN o dată pe lună.
Trebuie efectuate teste ale funcţiei hepatice înainte de începerea tratamentului. Aceste teste trebuie repetate lunar în primele 6 luni de tratament şi după cum se indică clinic ulterior.
Criterii pentru intreruperea tratamentului
• Lipsa de raspuns clinic si biochimic (AAL si PBG) la tratament
• Hipersensibilitate severă (de exemplu, anafilaxie) la substanţa activă sau la oricare dintre excipienţii
Reacţie anafilactică: În studiile clinice, s-a produs anafilaxie la un pacient care avea antecedente de astm bronșic alergic şi atopie. Semnele şi simptomele anafilaxiei trebuie monitorizate. Dacă se produce anafilaxie, administrarea acestui medicament trebuie întreruptă imediat şi trebuie instituit un tratament medical adecvat.
• Toxicitate semnificativa:
Creşteri ale concentrațiilor plasmatice ale transaminazelor: S-au observat creşteri ale concentrațiilor plasmatice ale transaminazelor la pacienţii trataţi cu givosiran. Creşteri ale concentrațiilor plasmatice ale transaminazelor s-au produs, mai ales, între 3 şi 5 luni după începerea tratamentului. Întreruperea sau oprirea tratamentului trebuie luată în considerare în caz de creşteri ale concentrațiilor plasmatice ale transaminazelor relevante clinic. După întreruperea terapiei,în cazul îmbunătăţirii ulterioare a concentraţiilor plasmatice ale transaminazelor, poate fi luată în considerare reluarea tratamentului, cu o doză de 1,25 mg/kg. Există date limitate privind eficacitatea şi siguranţa dozei mai mici, în special la pacienţii care au prezentat anterior creșteri ale concentraţiilor plasmatice ale transaminazelor. Nu există date privind creşterea secvenţială a dozei de 1,25 mg/kg la doza de 2,5 mg/kg după creşteri ale concentrațiilor plasmatice ale transaminazelor.
Efecte asupra funcţiei renale: În timpul tratamentului cu givosiran au fost raportate creşteri ale creatininemiei şi scăderi ale GFRe. În studiul controlat cu placebo, creşterea mediană a creatininemiei în luna 3 a fost de de 6,5 μmol/l (0,07 mg/dl) şi a fost rezolvată sau stabilizată până în luna 6 în condițiile continuării tratamentului lunar cu doza de givosiran 2,5 mg/kg. Progresia insuficienţei renale a fost observată la unii pacienţi cu boală renală preexistentă. În astfel de cazuri, este necesară monitorizarea atentă a funcţiei renale în timpul tratamentului.
Prescriptori
Medicii din specialităţile hematologie, gastroenterologie, medicina interna, neurologie, cardiologie, dermatologie, genetica medicală, şi pediatrie